Thuốc đặc trị COVID-19: Không còn xa nữa
Có vẻ thuốc đặc trị COVID-19 không còn xa vời nữa khi tiến trình phát triển có nhiều bước tiến tích cực, đã có thuốc được phê duyệt điều trị chính thức, có thuốc được cấp phép sử dụng khẩn cấp.
Hiện thế giới đang hứng chịu làn sóng COVID-19 mới do biến thể Delta (mà Tổ chức Y tế Thế giới (WHO) vừa cảnh báo sẽ là biến thể áp đảo trong đại dịch này thời gian tới) hoành hành. Số ca nhiễm đang tăng báo động không chỉ ở các nước tiêm chủng còn ít mà cả ở các nước đã phủ sóng vaccine đủ rộng, theo đó, số người phải nhập viện tới đây sẽ nhiều hơn.
Đã có thuốc đầu tiên được phê duyệt điều trị
Bên cạnh việc khẩn trương phủ sóng vaccine để ngăn các biến thể - đặc biệt biến thể Delta - lây lan thêm nữa thì công tác nghiên cứu, phát triển, bào chế, thử nghiệm và sản xuất được loại thuốc đặc trị COVID-19 đang là vấn đề cấp thiết hơn bao giờ hết. Tin khả quan, có vẻ thuốc đặc trị COVID-19 không còn xa vời nữa khi quá trình tìm kiếm đang có nhiều bước tiến tích cực.
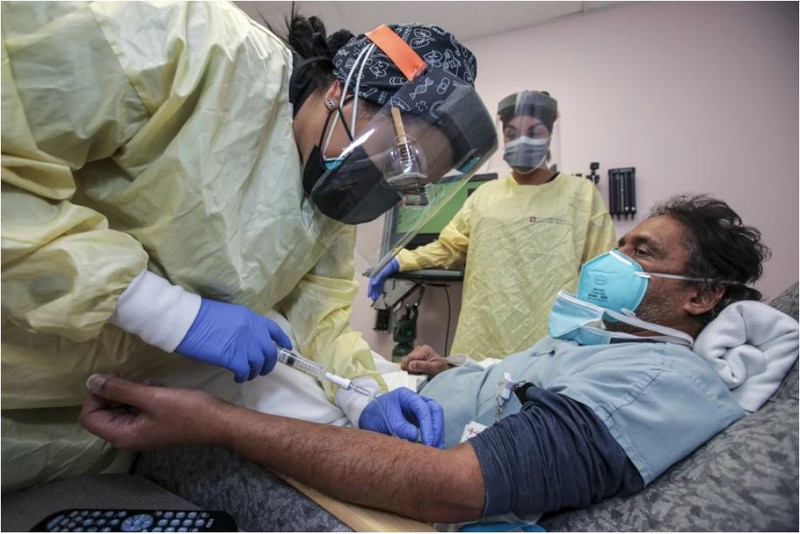
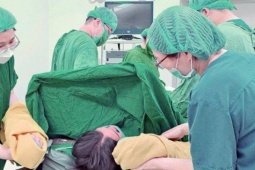
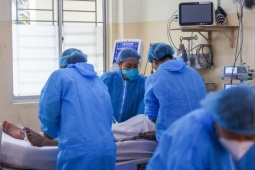
Tiêm kháng thể đơn dòng cho bệnh nhân COVID-19 tại bệnh viện Desert Valley ở TP Victorville, bang California (Mỹ). Ảnh: Infan Khan/ LOS ANGELES TIMES
So với các tiến trình phát triển thuốc trước đây thì tốc độ phát triển thuốc đặc trị COVID-19 diễn ra khá nhanh. Theo trang tin khoa học Genengnews.com, hiện một số ứng viên thuốc tiềm năng đã qua giai đoạn nghiên cứu phát triển, tới giai đoạn thử nghiệm lâm sàng trên người thứ hai và thứ ba, cũng như đang xin nhà chức trách cấp phép đưa vào sử dụng.
Một thông tin mang đến nhiều hy vọng, trang web tập đoàn dược phẩm Roche (Thụy Sĩ) ngày 20-7 cho biết Bộ Y tế - Lao động và Phúc lợi Nhật đã đồng ý cấp phép đưa thuốc Ronapreve, sản phẩm của Roche và Công ty Regeneron (Mỹ), vào điều trị bệnh nhân COVID-19 từ nhẹ tới vừa.
Ronapreve là sự kết hợp của hai kháng thể đơn dòng (casirivimab và imdevimab) và được thiết kế để ngăn chặn sự lây nhiễm SARS-CoV-2. Thuốc này có khả năng chống lại nhiều biến thể, kể cả Delta. Ronapreve đã qua giai đoạn thử nghiệm thứ ba, được thực hiện trên bệnh nhân không phải nhập viện. Ronapreve giảm 70% nguy cơ phải nhập viện và tử vong đến 70% cũng như giảm thời gian phát triệu chứng xuống bốn ngày.
Như vậy, Nhật là nước đầu tiên phê duyệt đưa Ronapreve vào điều trị COVID-19. Trước đó, Ronapreve cũng được nhiều nước và khu vực chấp nhận đưa vào sử dụng khẩn cấp và tạm thời như Mỹ, Ấn Độ, Canada, Thụy Sĩ, Liên minh châu Âu.
Nhiều ứng viên được cấp phép sử dụng khẩn cấp
Ngoài Ronapreve, theo thống kê của Genengnews.com còn có nhiều ứng viên tiềm năng khác. Ứng viên Sotrovimab của công ty công nghệ sinh học (CNSH) Vir Biotechnology (Mỹ) và công ty dược GlaxoSmithKline (Anh) là kháng thể đơn dòng có khả năng chống lại nhiều biến thể như Alpha, Beta, Gamma, Epsilom, Iota và cả Delta. Sotrovimab đã được Cơ quan Quản lý thực phẩm và dược phẩm Mỹ (FDA) cấp phép đưa vào sử dụng khẩn cấp với các bệnh nhân từ 12 tuổi trở lên ở thể nhẹ và vừa có nguy cơ tiến triển nặng. Dự kiến hồ sơ đăng ký sinh phẩm của Sotrovimab sẽ được nộp lên FDA trong nửa cuối năm 2021.
Ứng viên Lenzilumab của công ty CNSH Humanigen (Mỹ) là một kháng thể đơn dòng được thiết kế ngăn ngừa và điều trị rối loạn chức năng phổi và hội chứng suy hô hấp cấp tính ở các trường hợp nhiễm virus SARS-CoV-2 diễn tiến nghiêm trọng.
Ở giai đoạn thử nghiệm thứ ba, so với dùng giả dược, bệnh nhân dùng Lenzilumab được cải thiện khả năng sống mà không cần thông khí (SWOV) ở mức tương đối 54% và cao tới 92% ở những bệnh nhân dùng cả corticosteroid và remdesivir của công ty dược Gilead Sciences (Mỹ). Humanigen đã xin FDA cấp phép đưa Lenzilumab vào sử dụng khẩn cấp điều trị bệnh nhân COVID-19 nhập viện.
Từ tháng 4 đến nay, ứng viên liệu pháp sinh học tế bào Zofin của công ty CNSH Organicell Regenerative Medicine (Mỹ) đã qua hai đợt thử nghiệm ở Ấn Độ trên các bệnh nhân từ vừa đến nặng và kết quả rất hứa hẹn. Tháng 5, cơ quan quản lý thuốc của Pakistan đã đồng ý sử dụng Zofin điều trị cho một bệnh nhân COVID-19 là một bác sĩ nhiễm bệnh đến nguy kịch phải nằm trong phòng chăm sóc đặc biệt. Việc đồng ý đưa Zofin vào điều trị một số trường hợp riêng lẻ cũng có ở Ai Cập và Mỹ. Theo báo cáo về việc điều trị bằng Zofin đăng trên báo Frontiers in Medicine thì tình trạng lâm sàng và đường thở của các bệnh nhân được cải thiện, tình trạng mê sảng cấp tính được giải quyết hoàn toàn.
Tháng 5, ứng viên CERC-002 do công ty CNSH Cerecor (Mỹ) mua lại từ công ty CNSH Kyowa Kirin (Nhật) khi CERC-002 ở giai đoạn thử nghiệm lâm sàng, được FDA cấp trạng thái Fast Track (tạo điều kiện phát triển thuốc điều trị tình trạng nghiêm trọng đe dọa tính mạng và đáp ứng nhu cầu khẩn cấp về y tế). Kháng thể đơn dòng CERC-002 được phát triển nhằm điều trị các bệnh nhân COVID-19 nhập viện. Dữ liệu thử nghiệm giai đoạn 2 được thực hiện trên các bệnh nhân COVID-19 bị suy hô hấp cấp tính cho thấy so với các bệnh nhân nhận giả dược thì tỉ lệ sống và không còn suy hô hấp của các bệnh nhân nhận một liều CERC-002 cao hơn. Hiệu quả cao nhất ở bệnh nhân trên 60 tuổi, đối tượng thường có bệnh nền.
Ứng viên kháng thể đa dòng SAB-185 của công ty CNSH SAb Biotherapeutics (Mỹ) được thiết kế để cung cấp miễn dịch thụ động. SAB-185 bắt đầu quá trình thử nghiệm giai đoạn 2 trên bệnh nhân từ tháng 4.
Là một dạng khí dung hít đưa trực tiếp vào phổi bệnh nhân, ứng viên SNG001 của công ty CNSH Synairgen (Anh) được cho có khả năng kháng lại các biến thể Alpha và Beta. SNG001 đã qua giai đoạn thử nghiệm thứ hai với các bệnh nhân nặng tới mức khó thở. Kết quả cho thấy các bệnh nhân được điều trị bằng SNG001 có khả năng hồi phục cao gấp 3,41 lần so với các bệnh nhân được cho dùng giả dược. Hiện ứng viên thuốc này đang trong quá trình thử nghiệm giai đoạn 3 và kết quả sẽ được công bố vào nửa cuối năm nay.
Từ tháng 4, ứng viên kháng thể đơn dòng BRII-196/BRII-198 của công ty CNSH Brii Biosciences (hợp tác giữa Mỹ và Trung Quốc) đã được Viện Dị ứng và Bệnh truyền nhiễm quốc gia Mỹ cho phép đưa vào thử nghiệm giai đoạn 3 trên các bệnh nhân có rủi ro cao bệnh tiến triển nặng.
Các thông tin về các ứng viên thuốc trên cho thấy viễn cảnh có được thuốc đặc trị COVID-19 giúp chấm dứt đại dịch đã hiển hiện gần. Với tiến trình cụ thể như trên thì chúng ta hoàn toàn có thể hy vọng thuốc đặc trị COVID-19 sẽ có mặt trong nửa cuối năm 2021 này.•
|
25% là tỉ lệ bệnh nhân nhập viện tử vong ở Mỹ thời điểm tháng 3 và tháng 4 năm ngoái khi dịch đang hoành hành nặng, theo TS ARTURO CASADEVALL tại ĐH John Hopskin (Mỹ). Tuy nhiên, theo ông, “tình hình hôm nay tốt hơn nhiều” và một phần lớn là nhờ thuốc men. |
|
Giải pháp trước mắt: Tận dụng các loại thuốc hiện có Song song với việc khẩn trương phát triển thuốc đặc trị COVID-19, các nước đang áp dụng giải pháp tình thế: Tận dụng các loại thuốc hiện có (thuốc kháng các loại virus khác, thuốc trị viêm khớp…) trong cứu chữa bệnh nhân COVID-19. WHO ngày 6-7 khuyến nghị dùng các loại thuốc trị viêm khớp Actemra của Roche và Kevzara của Sanofi kết hợp corticosteroid cho bệnh nhân COVID-19, sau khi có dữ liệu thử nghiệm trên 11.000 bệnh nhân cho thấy thuốc giúp giảm nguy cơ tử vong. Trước đó, ngày 24-6, FDA (Mỹ) đã cấp phép sử dụng khẩn cấp với Actemra với bệnh nhân nhập viện (không dùng với người nhiễm COVID-19 không nhập viện). Loại thuốc duy nhất Liên minh châu Âu phê duyệt điều trị COVID-19 đến lúc này là thuốc Remdesivir (thuốc kháng virus Ebola và virus Marburg) của Gilead Science. Tại Ấn Độ, công ty dược Hetero Labs của nước này đang chờ nhà chức trách y tế cấp phép sử dụng khẩn cấp thuốc Molnupiravir (kháng virus cúm) vào điều trị COVID-19. |
Nhật trở thành quốc gia đầu tiên phê chuẩn thuốc kháng thể điều trị COVID-19 Ronapreve do hãng dược phẩm Thụy Sĩ Roche...
Nguồn: [Link nguồn]