Kit xét nghiệm của Công ty Việt Á không được WHO chấp thuận cho quy trình sử dụng khẩn cấp
Theo danh sách "SARS‐CoV‐2 IVDs: sản phẩm không được chấp thuận cho EUL" đăng tải trên website chính thức của Tổ chức Y tế thế giới (WHO), cập nhật ngày 10-12, có tên kit test của Công ty Cổ phẩn Công nghệ Việt Á.
Vào cuối tháng 4-2020, thông tin từ một cuộc họp báo do Bộ Khoa học - Công nghệ tổ chức cho hay bộ kit xét nghiệm Covid-19 LightPower iVA SARS-CoV-2 1st RT-rPCR KIT do Công ty Cổ phần Công nghệ Việt Á sản xuất đã được Tổ chức Y tế Thế giới (WHO) chấp thuận.
Sản phẩm được đánh giá theo Quy trình Danh sách Sử dụng Khẩn cấp (EUL) và cấp mã số EUL 0524-210-00.
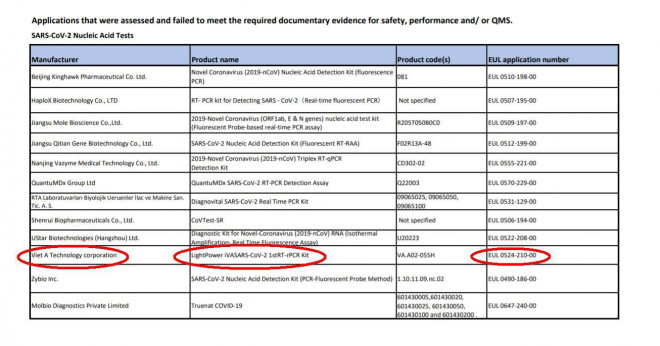
Trang 2 trong danh sách "SARS‐CoV‐2 IVDs: sản phẩm không được chấp thuận cho EUL" đang nằm trên website của WHO lại có tên sản phẩm này, gây nhiều thắc mắc (Ảnh chụp màn hình từ who.int)
Tuy nhiên, theo bản cập nhật ngày 10-12-2021, sản phẩm này lại nằm trong danh sách mang tên "SARS‐CoV‐2 IVDs: sản phẩm không được chấp thuận cho EUL" đăng tải trên website chính thức của WHO, cũng với mã số EUL 0524-210-00.
Cụ thể, sản phẩm này nằm trong mục "Các ứng dụng đã được đánh giá và không đáp ứng được các bằng chứng, tài liệu cần thiết về độ an toàn, hiệu suất và/hoặc hệ thống quản lý chất lượng - xét nghiệm axit nucleic SARS-CoV-2".
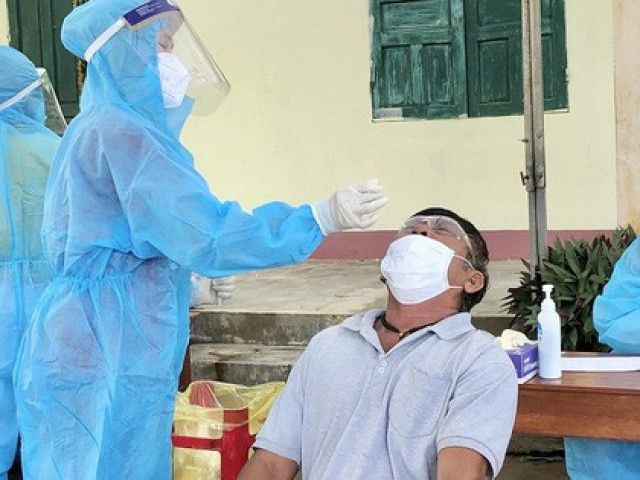
Kit test của Công ty Việt Á
"SARS‐CoV‐2 IVDs" là danh sách sử dụng khẩn cấp của WHO dành cho các chẩn đoán In vitro SARS-CoV-2; trong khi EUL là quy trình lập danh sách sử dụng khẩn cấp của WHO.
EUL dựa trên rủi ro để đánh giá và liệt kê các vắc-xin, phương pháp điều trị và chẩn đoán in vitro chưa được cấp phép, mục đích cuối cùng là xem xét khả năng tạm thời cung cấp các sản phẩm này cho những người bị ảnh hưởng bởi tình trạng khẩn cấp về sức khỏe cộng đồng.
EUL sẽ như một tài liệu tham khảo, hỗ trợ các cơ quan của Liên Hiệp Quốc và các quốc gia thành viên trong việc chấp nhận sử dụng và mua sắm các sản phẩm, dựa trên một bộ dữ liệu cần thiết về chất lượng, an toàn, hiệu quả và hiệu suất có sẵn.
Mục này gồm 12 sản phẩm, còn có tên một số sản phẩm của Công ty Dược phẩm Kinghawk Bắc Kinh, Công ty Công nghệ sinh học HalopX, Công ty Công nghệ y tế Vazyme Nam Kinh, Công ty Công nghệ sinh học UStar Hàng Châu, Tập đoàn QuantuMDx…
Trước đó, báo cáo công khai của WHO-EUL vào tháng 10-2020 về sản phẩm này có ghi rõ: “Kết quả: không được chấp thuận”.
Tổ chức này giải thích thêm rằng sản phẩm “không đủ điều kiện tham gia đấu thầu của WHO”. Theo đó, Công ty Cổ phần Công nghệ Việt Á được yêu cầu cung cấp thông tin cập nhật về tình trạng của hệ thống quản lý chất lượng của họ.
Sau khi xem xét tài liệu do Công ty Cổ phần Công nghệ Việt Á đệ trình nhằm hỗ trợ đánh giá bàn về hệ thống quản lý chất lượng của nhà sản xuất, thông tin nộp lên không phải là bằng chứng đầy đủ về việc tuân thủ ISO 13485: 2016 Trang thiết bị y tế - Hệ thống quản lý chất lượng - Yêu cầu đối với các mục đích quy định và các yêu cầu được mô tả trong "hướng dẫn về yêu cầu phân loại nhỏ: Chẩn đoán trong ống nghiệm (IVDS) Phát hiện axit nucleic SARS-COV-2, PQDX 347".
Tổng Giám đốc Công ty CP Công nghệ Việt Á Phan Quốc Việt bị cáo buộc thông đồng với lãnh đạo các cơ sở y tế để...
Nguồn: [Link nguồn]